华领医药成功完成III期注册临床研究
(医药健闻2020年12月18日讯)
华领医药今天宣布其第二项III期注册临床研究DAWN(黎明研究,也称HMM0302)28周安全评估阶段的核心结果。
- 在超过1200例中国患者中,成功完成两项53周III期注册临床研究。在新冠疫情全球大流行情况下,DAWN(黎明研究,也称HMM0302)28周安全性评估开放治疗期试验成功,高质量完成了52周黎明研究
- 针对二甲双胍足量治疗(1500mg/日)失效的中国2型糖尿病患者,在黎明研究的24周和52周治疗期间,多扎格列艾汀(dorzagliatin)均表现出良好的安全性和耐受性
- 不同于很多其它口服糖尿病药物,多扎格列艾汀与二甲双胍联合用药不会增加低血糖事件发生率:整个52周黎明研究期间,低血糖事件(血糖低于3mmol/L)发生率低于1%
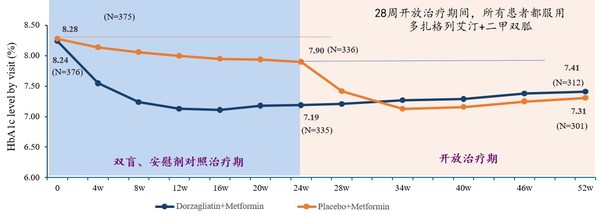
- 24周治疗期结束时,评估主要疗效终点,多扎格列艾汀治疗组糖化血红蛋白(HbA1c)较基线降低1.02%,餐后两小时血糖值(2h-PPG)较基线显著降低5.45mmol/L,具有显著的统计学意义,p值小于0.0001
- 在降低糖化血红蛋白方面,多扎格列艾汀能够快速起效,24周和52周治疗期间均持续有效
- 在平均糖尿病患病史近6年,且二甲双胍足量治疗(1500mg/日)失效的患者中,黎明研究显示,相比于安慰剂对照组,多扎格列艾汀治疗组患者的HOMA2-β显著增加、HOMA2-IR降低,表明多扎格列艾汀能够持续改善β细胞功能和胰岛素抵抗。类似的结果也出现在SEED(播种研究,也称HMM0301)中,该试验平均糖尿病患病史为1年,且患者从未接受过糖尿病药物治疗
- 首次由中国生物技术公司推出全球首创的口服治疗新药 -- 葡萄糖增敏剂,其全新作用机制直击2型糖尿病的根本病因,可以改善胰岛素抵抗和β细胞功能
2型糖尿病是一种全球性疾病,肥胖、久坐不动和营养不均衡等不良生活习惯日益加剧了这一疾病的流行。糖尿病以高血糖为特征,长期暴露在高血糖环境下会导致多种器官的长期损伤、功能障碍和衰竭,进而导致微血管并发症,如视网膜病变、肾病和神经病变,以及大血管并发症,如中风、心肌梗死和外周动脉疾病。因此,糖尿病是一种“价格高昂”的疾病,导致各种医疗费用的不断增加。综合上述因素,医学界至今尚未达到糖尿病的治疗目标。2020年7月,美国糖尿病协会等机构在《糖尿病治疗》上共同发表了一篇共识性报告,题为《成人2型糖尿病患者的糖尿病自我管理教育和支持》,文章指出,“自2005年以来,尽管糖尿病药物开发和技术治疗模式都取得了进步,但在改善临床目标方面,鲜有重大突破。事实上,2010年至2016年间,糖尿病治疗的成果甚至呈现停滞或倒退趋势”。目前,糖尿病药物的基本问题在于,现有治疗方法未能从源头上实现对2型糖尿病的精准施治,未能解决胰岛素抵抗和β细胞功能退化的根本病因。作为全球首创的葡萄糖激酶激活剂口服药物,多扎格列艾汀的作用机制是修复葡萄糖激酶,而葡萄糖激酶能够靶向作用于葡萄糖传感器功能,重塑血糖稳态,具有恢复人体血糖自主调控的潜力。广泛的临床数据表明,多扎格列艾汀可以有效控制血糖,显著降低糖化血红蛋白水平和餐后血糖水平(餐后两小时血糖值,2h-PPG),在超过1200例中国患者中开展的2项III期临床试验中,低血糖事件(血糖低于3mmol/L)发生率低于1%。
DAWN(黎明研究,也称HMM0302)是华领医药的第二项III期注册临床研究,共历时53周,包括52周治疗和后续1周安全性随访,在767名2型糖尿病患者中展开,目的是研究多扎格列艾汀(75mg/次,每日两次)的有效性和安全性。前24周为双盲、安慰剂对照治疗,用以评估试验的主要疗效和安全性终点;后28周为开放治疗期,用以持续观察和评估多扎格列艾汀的安全性。在24周双盲治疗期和28周开放性治疗期内,多扎格列艾汀均显示出良好的安全性和耐受性,治疗组与对照组的不良事件发生率相似,52周治疗期间内低血糖(血糖低于<3 mmol/L)发生率低于1%。同时,作为2型糖尿病的主要标志,HOMA2-IR测量显示,患者的胰岛素抵抗指标持续性降低。
2020年7月,华领医药宣布黎明研究在双盲试验期达到主要疗效和安全性终点,具有良好的安全性和耐受性,疗效显著。整个52周治疗的疗效和安全性结果基于核心数据分析。28周开放治疗期间,原来接受安慰剂+二甲双胍治疗的患者改为服用多扎格列艾汀+二甲双胍。下图说明了整个52周期间,两个治疗组的糖化血红蛋白下降水平。
黎明研究的主要对象为平均糖尿病患病史近6年,且二甲双胍足量治疗(1500mg/日)失效的患者;此前的首个III期注册临床研究播种研究的主要对象为平均糖尿病患病史为1年,且从未接受过糖尿病药物治疗的患者。在两组不同的人群中,多扎格列艾汀表现出了同样积极的疗效和安全性结果,不仅如此,多扎格列艾汀在两项试验中均能够持续改善β细胞功能和胰岛素抵抗,显著降低餐后两小时血糖值。
自2010年9月就担任华领医药产品管线管理顾问委员会(Portfolio Advisory Board)成员的Bennett M. Shapiro博士表示:“我代表顾问委员会对华领医药表示祝贺,你们在2型糖尿病治疗方面取得了全球性的突破性创新。在过去的10年里,我们一直为多扎格列艾汀的临床项目提供指导建议,我们很兴奋地看到,多扎格列艾汀已经成功完成了两项III期注册试验,并且在1200多名中国2型糖尿病患者中证明了它的安全性和有效性。我们期待着与华领医药继续合作,为进一步探索多扎格列艾汀在糖尿病治疗和人体代谢调控方面的独特作用机制提供指导和建议。”
黎明研究设计(多扎格列艾汀联合二甲双胍的疗效和安全性评估)
黎明研究是一项在二甲双胍足量治疗失效的2型糖尿病患者中展开的随机、双盲、安慰剂对照的III期注册临床研究,共纳入767位受试者。在整个52周治疗期内,受试者每天服用1500mg二甲双胍(格华止®)作为基础治疗,并以1:1的比例随机接受每日两次75mg多扎格列艾汀或安慰剂治疗。前24周双盲治疗期评估多扎格列艾汀的主要疗效终点,用以评价多扎格列艾汀与二甲双胍联合用药的有效性和安全性,后28周为开放治疗期,所有患者均接受每日两次75mg多扎格列艾汀用药治疗。该研究由中日友好医院杨文英教授领衔,在中国72家临床中心进行。(临床研究登记注册号:NCT03141073)
播种研究设计(多扎格列艾汀单药的安全性和有效性评估)
播种研究是一项在从未接受过糖尿病药物治疗的2型糖尿病患者中展开的随机、双盲、安慰剂对照的III期注册临床研究,共纳入463位受试者。整个研究历时53周,包括52周治疗和后续1周安全性随访,前24周为随机双盲、安慰剂对照的疗效和安全性研究,受试者以2:1比例入组,随机接受一天两次口服75mg多扎格列艾汀或安慰剂的治疗。后28周为开放性药物治疗的药物安全性研究,治疗期间,所有患者均接受一天两次口服75mg多扎格列艾汀进行治疗。同时,临床研究者需严格贯彻中华医学会糖尿病学分会的指南要求,教育受试者加强锻炼、控制饮食,并按时进行自我血糖监控。该研究由中华医学会糖尿病分会现任主任委员朱大龙教授领衔,在中国40家临床中心开展。(临床研究登记注册号:NCT03173391)