中国药监局批准安尼可治疗局部晚期或转移性鳞状非小细胞肺癌适应症
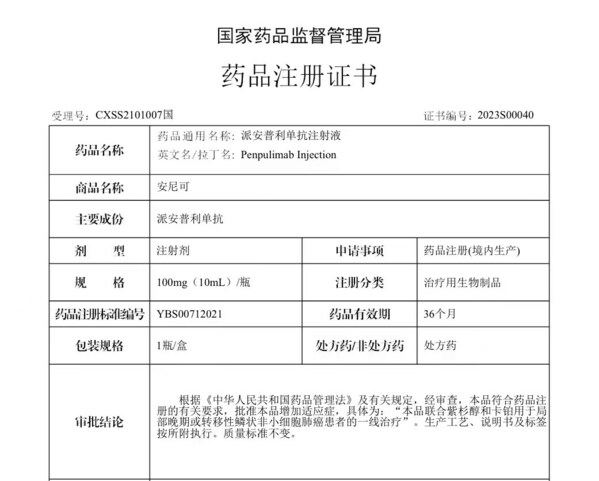
(医药健闻2023年1月16日讯)2023年1月13日,正大天晴与康方生物共同宣布,中国国家药品监督管理局(NMPA)已批准双方共同开发的肿瘤免疫创新药物派安普利单抗注射液(商品名:安尼可®)联合紫杉醇和卡铂一线用于局部晚期或转移性鳞状非小细胞肺癌的治疗。
派安普利单抗获得NMPA批准联合紫杉醇和卡铂一线治疗局部晚期或转移性鳞状NSCLC的适应症是基于关键性III期临床试验(AK105-302)的研究结果。
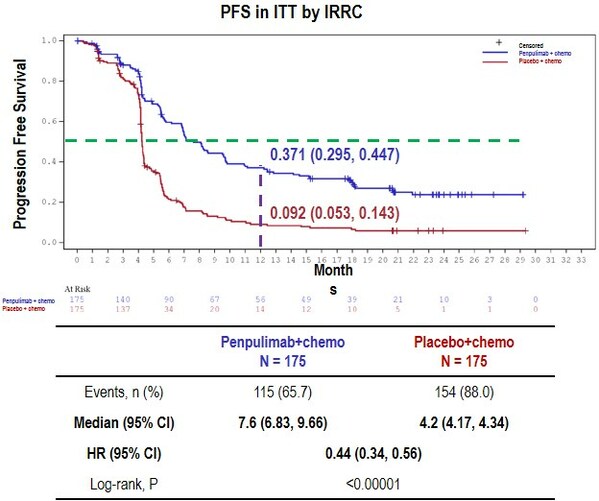
AK105-302研究共入组350例鳞状NSCLC患者,以1:1比例随机入组并接受派安普利单抗200mg联合卡铂AUC5+紫杉醇175mg/m2 Q3W治疗或安慰剂200mg联合卡铂AUC5+紫杉醇175mg/m2 Q3W治疗4周期,随后进入维持治疗。主要研究终点为IRRC评估的无进展生存期(PFS),次要研究终点包括总生存期(OS)、客观缓解率(ORR)、疾病控制率(DCR)、研究者评估的无进展生存期(PFS)、持续缓解时间(DoR)及安全性等。
研究结果显示,接受派安普利单抗联合化疗的局部晚期或转移性鳞状NSCLC患者,中位PFS为7.6个月(95% CI: 6.83-9.66),对比化疗组的4.2个月(95% CI: 4.17-4.34)显著延长3.4个月,HR=0.44(95%CI: 0.34-0.56),p<0.00001,疾病进展或死亡风险下降56%;ORR高达71.4%,相较于化疗组ORR(44.0%)显著提升27.4%,P<0.00001。
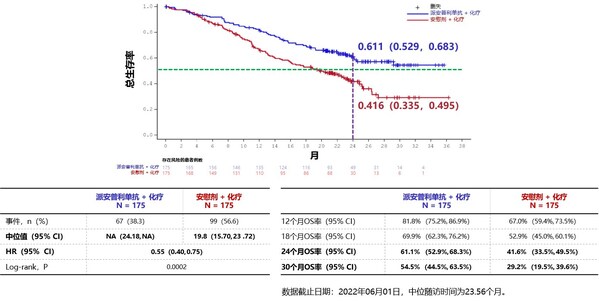
接受派安普利单抗联合化疗的局部晚期或转移性鳞状NSCLC患者,中位OS尚未成熟,化疗组的中位OS 19.8个月(95% CI: 15.70-23.72),HR=0.55(95%CI: 0.40-0.75),p=0.0002,疾病进展或死亡风险显著下降45%;派安普利单抗联合化疗组30个月的OS率高达54.5%(95% CI: 44.5%-63.%),为患者更长生存获益带来希望。
安全性方面,派安普利单抗联合化疗组的耐受性良好,与化疗相比,治疗期间发生的不良事件(TEAE)无显著增加。派安普利单抗联合化疗组与化疗组≥3级TEAE发生率分别为69.4%和69.7%;≥3级irAE发生率仅为2.9%。其中在派安普利单抗联合化疗组中,仅1例(0.6%)发生≥3级免疫介导性肺炎。相较其他同类型研究数据,派安普利单抗≥3级TEAE发生率更低,展现出优异的安全性。
基于AK105-302研究的优秀结果,NMPA批准派安普利单抗联合化疗一线用于局部晚期或转移性鳞状NSCLC患者的治疗。此外,派安普利单抗在非鳞NSCLC的治疗也有进一步的探索,期待研究能够取得阳性结果,为更多患者带来获益。
派安普利单抗是目前唯一采用IgG1亚型并进行Fc段改造的新型PD-1单抗。在重链Fc端利用基因工程技术进行氨基酸突变,形成Fc silencing(Fc效应沉默),消除与Fc受体结合的能力。这样的改造一方面完全去除了ADCC/ADCP/CDC效应,显著减少效应T细胞耗损,另一方面,Fc段改造降低ADCR效应,减少IL-8的释放,进一步增强免疫疗效。此外,ADCR效应的降低还意味着IL-6的释放减少,从而减少irAEs,表现为临床数据上安全性的提升。
2021年8月5日,派安普利单抗获得NMPA批准用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤成人患者的治疗。
此外,派安普利单抗治疗鼻咽癌、肝细胞癌、头颈部肿瘤及胃癌等多个瘤种的研究亦在稳步推进当中,这些研究或已在ASCO等国际舞台多次亮相,或已完成入组等待最终数据的揭晓,派安普利单抗的临床前景值得期待。