信达生物IBI3003获得美国FDA快速通道资格认定

(医药健闻2026年1月28日讯)
信达生物制药集团宣布其抗GPRC5D/BCMA/CD3三特异性抗体IBI3003获得美国食品和药物监督管理局(FDA)授予快速通道资格(Fast Track Designation, FTD),拟定适应症为接受过含一种蛋白酶体抑制剂(Pl)、一种免疫调节药物(IMiD)及一种抗CD38单抗的至少四线治疗的复发或难治性多发性骨髓瘤(R/R MM)。
IBI3003由信达生物专属Sanbody®平台构建,目前正在中国、澳大利亚和美国(即将启动)开展I/II期临床研究探索在R/R MM的有效性和安全性。
本文系作者个人观点,转载请注明出处!
赏
![]() 支付宝扫码打赏
支付宝扫码打赏
![]() 微信打赏
微信打赏
上一篇:已是最新文章
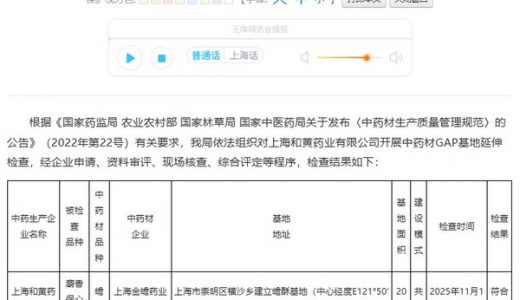
下一篇:上海首个动物药材GAP基地诞生