基石药业和泛生子联手打造的伴随诊断试剂盒获批,推动精准医疗发展
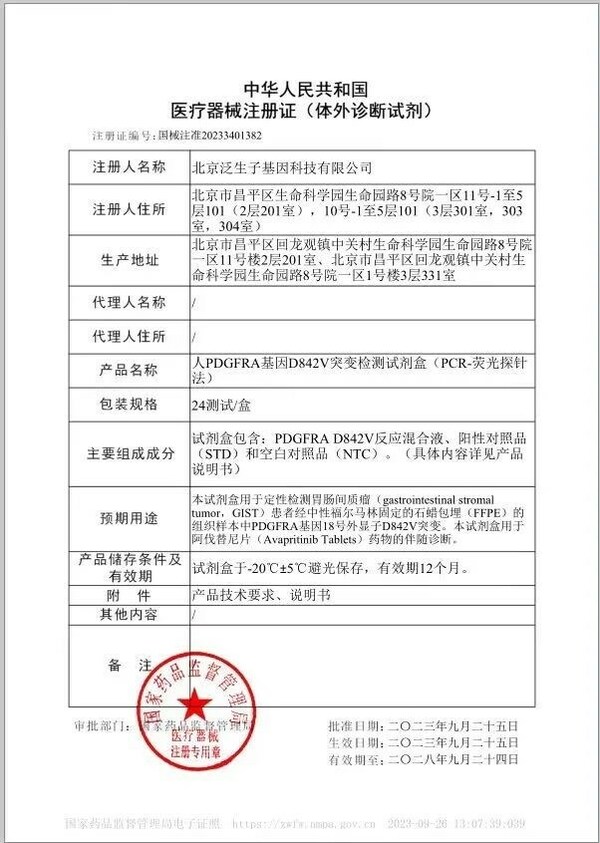
(医药健闻2023年10月17日讯)近日,泛生子注册的"人PDGFRA基因D842V突变检测试剂盒"获国家药品监督管理局(NMPA)批准,成为中国伴随诊断试剂指导原则出台后NMPA批准的首个以桥接路径开发的伴随诊断试剂盒。该试剂盒由泛生子与基石药业联合开发,可通过检测胃肠间质瘤(GIST)患者的PDGFRA基因突变,用于泰吉华®(通用名:阿伐替尼)药物的伴随诊断。
该试剂盒的上市,还实现了多项"首个":首个结合中国境内外药效数据批准上市的国产伴随诊断试剂盒;首个在《抗肿瘤药物的非原研伴随诊断试剂临床试验注册审查指导原则》和《与抗肿瘤药物同步研发的原研伴随诊断试剂临床试验注册审查指导原则》出台后以完整桥接路径上市的伴随试剂盒;首个药物和器械均获得NMPA优先审评的伴随试剂盒。
PDGFRA基因D842V突变的GIST患者一直缺乏有效治疗药物,而泰吉华®在PDGFRA基因外显子18突变(包括D842V突变)的不可切除性或转移性GIST中国患者中表现出优异的抗肿瘤活性,且安全性和耐受性良好,是中国首个获批用于治疗该疾病精准治疗的药物。该伴随诊断试剂盒是国内首个针对人PDGFRA基因D842V突变的试剂盒,以科学有效的临床数据作支撑,更精准的筛选出患者,匹配泰吉华®进行治疗,使患者得到更精准、更大的生存获益。
本文系作者个人观点,转载请注明出处!
赏
![]() 支付宝扫码打赏
支付宝扫码打赏
![]() 微信打赏
微信打赏